2月23日,友康生物联合权威媒体生物谷,邀请了行业资深专家同济大学附属东方医院干细胞基地GMP实验室主任贾文文主任和友康生物技术部总监余知翀老师,共同开展了“2023 GMP管理规范细胞药物开发培养基空中论坛”,会议取得圆满成功。
本次线上直播会议在两位专家的带领下,围绕间充质干细胞的制备质检、规模化培养以及GMP级干细胞培养基对MSC培养和药物申报的影响展开分享与讨论,会议内容干货满满,精彩纷呈。以下整理会议精粹,以飨读者。


虽然在干细胞的制备质检以及规模化培养这个领域,目前已经有很多的研究,但是仍然有很多新的理念和想法。众所周知,干细胞指的是具有自我更新能力和多项分化潜能的细胞类群。
干细胞凭借其两大特性为传统医学治疗疑难杂症带来希望,目前在心血管疾病、退行性疾病、炎症性疾病和消化系统疾病都已经展现出很大优势,可能会比目前的一些传统疗法得到一个更让大家期待的结果。
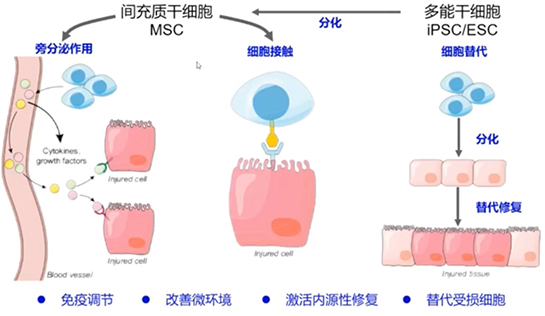
间充质干细胞通过旁分泌或者细胞激素的方式来发挥作用,这也是间充质干细胞目前在作为药物申报时,它的作用方式的解读,但是间充质干细胞很难解决功能细胞替代的这种模式。所以现在除了间充质干细胞报药以外,还有一类细胞就是ESC细胞和iPSC细胞分化的这种功能细胞,那么它完成的任务就是替代的这种模式。当一个疾病发生其实有几种原因,一种是功能性细胞受到了损伤,还有一种是微环境受到了破坏。在解决疾病过程中,有些治疗方式是通过间充质干细胞分泌的方式,有些是通过替代的方式。其实不管哪种方式,最终的目的都是来解决疾病的治疗。
干细胞药物研发面临的瓶颈问题目前有这三个,第一是适应症的选择,现在我们能够看到的选择,大多数还是参考了国外已经按照药品获批的一些间充质干细胞的适应症,从治疗效果上相对是比较明确的。第二是在细胞类型方面,间充质干细胞来源有很多,有羊膜、脐带、脂肪、牙髓等。其实大量研究发现,从不同组织来源的间充质干细胞分泌的细胞因子也有差异,而且它的RNA测序数据、单细胞测序数据,也会显示出组织来源的特异性,由此看来它在治疗方面也会有一定差异。第三个就是目前首先要考虑的问题,就是间充质干细胞的规模化生产,这个问题如果不解决,那么在临床研究里很难去做到疗效评估的一致性。做过间充质干细胞培养的人应该都知道,一个人做细胞培养最多只能达到几个亿的数量,而且我们在临床使用前还要对细胞进行质量评价,因此就需要大量的细胞检测。检测完再去临床使用时,实际上细胞数量已经很少了。
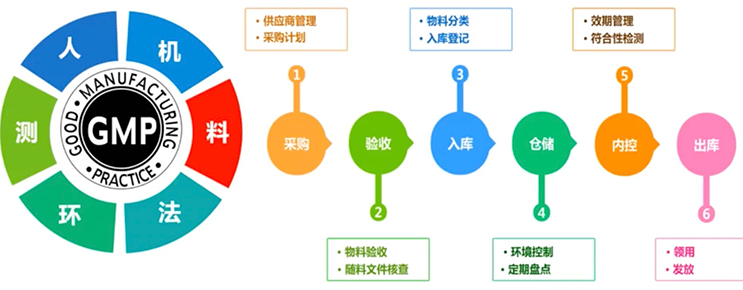
干细胞的生产,绝对不是一个简单的过程,实际上它需要一个完整的体系,要求达到人员、设备、用料、方法、环境、检测六个方面的完整性。细胞的培养本身可能没有那么复杂,但是你要把整个操作记录下来、有据可查,这是很困难的一件事情,所以对人员、组织构架、职权的管理,以及培训和考核监督等就成了核心,所有的东西都是围绕着人。设备问题,对于要把干细胞作为药品生产的企业是比较容易完成的,因为几乎所有的设备都有各种证件、校准和规范化操作。在物料管理这方面,实际上科研和临床研究有很大区别,在GMP管理体系里,要求相对比较规范,来确保干细胞的整个生产过程,尽可能把风险降到最低。工艺的优化、环境的标准和质量检测也是干细胞生产体系中不可缺少的一环。在整个过程中,不仅要有纸质化的系统,更要形成一套自动化管理系统,来保证整个生产管理体系的完整性。
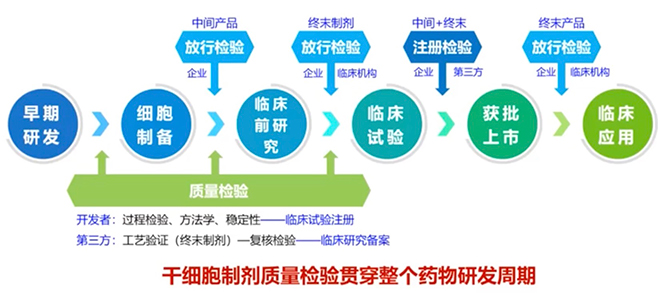
在间充质干细胞制备过程中有几个原则,第一规范化试剂耗材采购、接受、检验、贮存、发放、使用和运输;第二,所有世纪来源、作用明确,对人体无害,不影响细胞生物学活性;第三,不实用动物源性成分;第四,培养基添加物应为临床药品及产品;第五,制备区内设备定期进行质量管理评估、维护;第六,定期维护和管理设备、试剂和耗材。
间充质干细胞的培养方式有很多,比如传统2D、多层2D、多层固定床、3D微载体等方式,各有各的优势。间充质干细胞通过规模化扩增出来以后,接下来就是要去按照药品流程走。在质量体系评价里面,我们要考虑的就是安全性和有效性。因为细胞的类型不一样,它可能检测的内容也不太一样,在所有的检测方法里面,要注意就是所有的这些检测一定要按照要求去做准确性、精密度、耐用性、线性范围、专属性和检测限度和定量限度等,来证明你的检测方法出的报告是真实可信的。


2022年是我国干细胞行业令人欣喜的一年,国家和很多地方性政府都颁布了一些行业政策,发表了指导性意见,规范了行业的发展。不光是在国家政策方面,还有产品方面,也取得了很多突破。其中友康生物的一套干细胞原代传代培养基产品也取得了非常令人欣喜的成果,通过了IND申报。
结合之前客户的经验,我们捋出了一个与培养基相关的在MSC新药前期研发的大致流程。培养基现在大体是按照生产原料来监管,但是它实际上比原料更关键,这是干细胞药物开发的一个难点区域。在之前的申报过程中,我们逐步发现有五大方面的新药研发流程中培养基都起到了关键性作用。首先在细胞库的建立中,培养基的性能是否和冻存液匹配、冻存复苏后的性能、细胞种子库的指控标准以及细胞性能是否符合适应症要求,都与培养基相关。其次,在中试开发方面,培养基是否支持大规模培养、检验学是否能通过正常验评、质量标准的建立都会围绕着培养基性能展开。第三,在药物安全性评价中,培养基组分的安全性、必要性、毒性以及、残留物检测,也是至关重要的。第四,在药效学上培养基所生产的MSC是否能够满足药效,改善的空间如何。最后,在早期临床试验中,临床安全性、有效性评价,以及培养基的厂家是否支持下游公司的一个联合评审。这是现在大家普遍经历的申报流程。
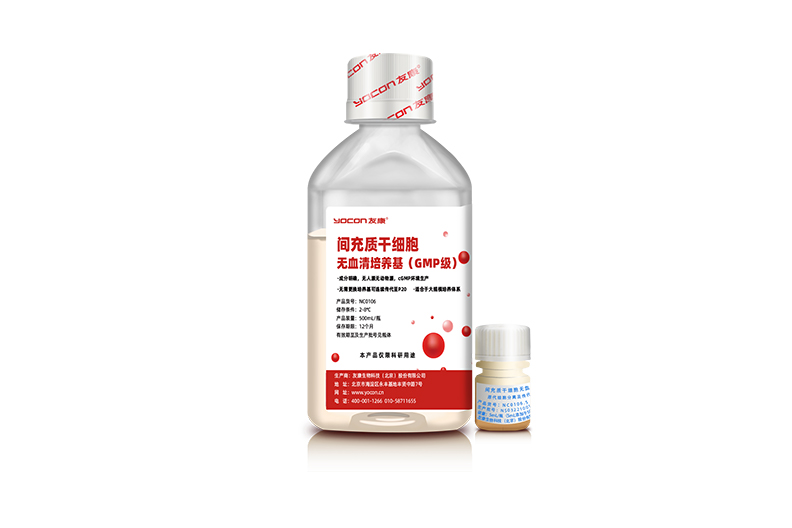
根据之前的经验,友康生物成功开发出了一个化学成分完全明确的GMP级间充质干细胞无血清培养基,用于更好地协助下游的药物申报客户进行报药。首先这款产品是一个化学成分完全明确、在B+A级的GMP无菌灌装生产线上生产的一个新品培养基,它的蛋白种类不超过20种,总含量低于1.5mg/ml,并且无人源、无动物源成分,所添加的蛋白全部为人工重组蛋白,目前已经获得美国FDA DMF的备案。其次,这款培养基解决了更换培养基的问题,一款产品无需更换即可实现原代及传代的培养。第三,适合细胞产品的大规模生产,以及3D的培养体系,达到了贴壁能力和细胞性能的平衡。
我们在建立细胞库的过程中,不光是培养基要求GMP级,所使用的冻存液也要求使用GMP级冻存液来实现报药过程中细胞库建立的真正安全,因为大家都不想有传统冻存液中DMSO的残留。友康生物同时也开发出了一款搭配GMP级培养基使用的GMP级玻璃化冻存液,它没有添加血清,没有添加任何蛋白,也没有添加DMSO,所有成分完全明确,同时这款冻存液也获得了DMF的备案。此外这款产品使用了玻璃化冻存技术,不用做程序降温,可以直接投放至-80℃,保存12小时后即可转移到液氮中进行长期冻存。第三,由于这款冻存液没有添加蛋白,所以它可以常温运输保存,运输存放成本大大降低。
这款GMP级培养基培养间充质干细胞的优势体现在这四个方面。首先,无血清以及化学成分明确体系养出来的细胞形态更加立体,短梭形更加明显,这是因为组分筛选所导致的,培养基里所有组分对细胞有益,所以它的形态学更加立体。第二,细胞的扩增倍数随着代次增加仍然维持着一个比较高的水平,细胞没有表现出明显的老化。第三,细胞的表面标志物的鉴定结果很好,阴性标志物是一些血细胞、淋巴细胞的免疫标志物,由于干细胞免疫源性低,所以它不表达这些阴性标志物,其鉴定结果一定不超过2%。阳性标志物中比较核心的是CD90和CD105,这款GMP级培养基在P11代次的表面标志物鉴定中所有的阴性标志物都在0.5%以下,所有阳性标志物都在99%以上,在P11代次都达到了这么好的一个效果,更何况低代次的细胞,由此看来可以说这款GMP级培养基完美达到了细胞鉴定的需求。第四,三系分化效果非常明显,这款GMP级培养基培养出的细胞染色率都非常的漂亮。
这款GMP级培养基培养出的间充质干细胞在质量检测中也有很好的表现。通过淋巴细胞的增殖抑制检验,它能够达到53.18%的抑制率,对TH1的抑制率达到了89.96%,对T17的抑制率达到了46.90%,对于Treg的达到了24.58%。这些数据我们没有进行任何的干预,很客观的反馈了干细胞自身的调节性的作用。
以上就是友康针对该产品的所进行的一些细胞检验学的工艺,更新的一些检验数据,我们也会持续发布。

精彩问答
Q1:对于间充质干细胞的培养,细胞检测学中对于培养基的残留是检测哪些物质的残留?
A1:根据我们的经验,目前在细胞检测学中对于培养基的残留普遍就是检测BSA(牛血清白蛋白)和抗生素和转铁蛋白的检测,目前我们已经申报成功的客户普遍都是检测这三种物质残留。
Q2:细胞冻存液中添加DMSO,经过冻存的细胞最后作用于人体,会对人的安全性有影响吗?怎么尽可能减小这种危害?
A2:因为DMSO作为传统冻存液中必要的添加物质,它残留于这个体系中,它本身对细胞有毒性,所以在经过冻存复苏工艺的细胞,需要有一个非常快速的操作。其次就是我们最终想要达到的一个目的是在细胞复苏之后,可以直接制备成制剂,然后回到人的体内,所以说我们肯定也是不希望添加DMSO的。现在对于目前传统的添加了DMSO的冻存液,我们对于复苏的细胞还需要一个三步清洗来制备成制剂的操作。此外,DMSO从冷冻到常温的过程中本身会放热,所以说理论上对于传统的冻存液需要在冰上有一个预冷的操作,这些操作非常麻烦,这也是大家不希望细胞冻存液中有DMSO。
Q3:冻存后的细胞复苏之后可以直接用于人体吗?
A3:目前来看这种方式是可行的,因为我们的这款GMP级冻存液中没有人白蛋白、没有DMSO,并且细胞冻存复苏的工艺很稳定,能保持一个很好的细胞活率,是可以稳定制成制剂的。我们说的三步清洗的步骤主要是考虑到目前市面上还存在的含有DMSO的冻存液来考虑的,对于我们这款GMP级冻存液是可以直接制备成制剂的。

 友康生物
友康生物 2023-03-08
2023-03-08 参展新闻
参展新闻



