近日,中共中央办公厅、国务院办公厅印发《关于进一步完善医疗卫生服务体系的意见》(以下简称《意见》),这不仅推动了医疗卫生事业的发展,也为干细胞行业迎来了新的曙光。
《意见》指出,提高医疗卫生技术水平。加强临床医学、公共卫生和医药器械研发体系与能力建设,发展组学技术、干细胞与再生医学、新型疫苗、生物治疗、精准医学等医学前沿技术。
一、干细胞的临床应用
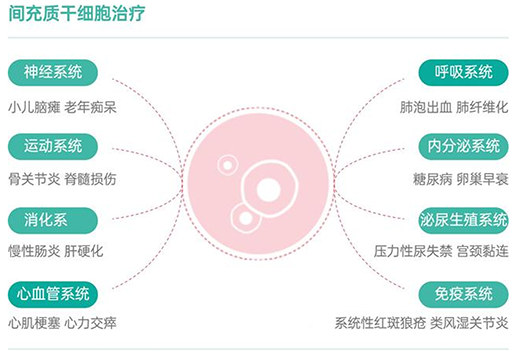
干细胞技术一直以来被视为“再生医学技术”,被誉为继药物治疗和手术治疗之后的第三次医学革命,是近年来国际医学前沿重点发展领域。而间充质干细胞(MSC)的应用则是目前干细胞行业中最火热的研究方向。
MSC凭借其免疫原性低、多向分化、组织修复等生物学特性,逐渐被研究用于治疗各个系统的疾病,它为一些严重及难治性疾病,如糖尿病、骨关节炎、肝病、溃疡性结肠炎、移植物抗宿主病、自身免疫性疾病等带来了新的希望。
二、干细胞的安全问题
目前已有大量研究发现干细胞具有巨大的临床应用前景,我国在干细胞基础和临床研究方面也取得了一些国际领先的成就,但是目前获批上市的干细胞产品寥寥无几。
怎么把理论与实践结合,研发出成熟的干细胞产品,这其中最关键的就是安全问题。《意见》指出,要把保障人民健康放在优先发展的战略位置,坚持以人民健康为中心。我们在干细胞的临床研究中要贯彻这一精神,不仅仅要考虑干细胞产品的疗效,更要考虑干细胞的安全性问题。
三、GMP级产品从源头降低安全风险
干细胞作为一种有活性的药物,必须确保进入临床的每一剂细胞质量都是可靠的,要保障干细胞药物安全性必须从源头降低安全风险。
在干细胞的培养过程中,优良的培养基是保障细胞安全性的第一关。培养基对细胞本身有一定的修饰作用,为细胞提供一个良好的生长环境。一款适用于药物申报的培养基,可以从源头大幅度降低适应症开发与质量控制方面的工作量,因此成分完全限定级别的无血清培养基广为推崇。
友康正是考虑到干细胞药物研发中最重要的安全性问题,开发了一系列GMP级产品,包括GMP级间充质干细胞无血清培养基和GMP级玻璃化细胞冻存液,来切实帮助用户解决在药物申报过程中面临的安全风险。
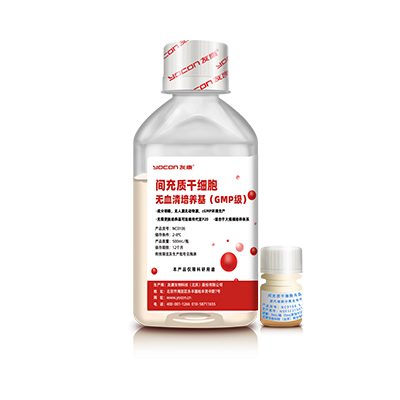
这款培养基化学成分完全明确,在B+A级的GMP无菌灌装生产线上生产,所添加蛋白全部为人工体系,种类不超过20种,总含量低于1.5mg/mL,并且无人源、无动物源成分,目前已经获得美国FDA DMF备案。此外它解决了更换培养基的问题,无需更换培养基即可实现原代及传代的培养。适合细胞产品的大规模生产,以及3D培养体系,达到了贴壁能力和细胞性能的平衡。
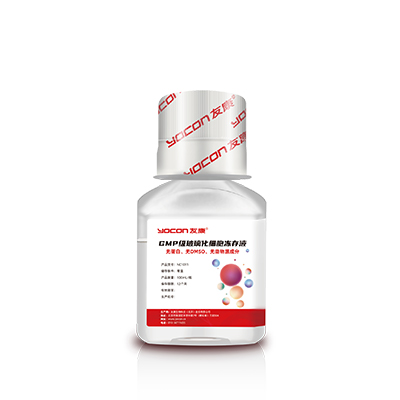
友康生物同时也开发出了一款GMP级玻璃化冻存液搭配GMP级培养基使用。这款冻存液无血清、无蛋白、无DMSO,所有成分完全明确,获得了DMF备案。这款产品使用了玻璃化冻存技术,无需程序降温,可以直接投放至-80℃,保存12小时后即可转移至液氮进行长期冻存。
随着研究的进展以及行业的规范化发展,未来干细胞有望以治疗具体疾病的形式来造福人类,友康生物也将不断投入研发,为下游用户提供更好的产品;坚持不忘初心,为世人的生命健康贡献力量。

 友康生物
友康生物 2023-03-31
2023-03-31 行业热点
行业热点



