8月17日,国家药品监督管理局药品审评中心为规范和引导人源性干细胞产品的药学研究,发布了《人源性干细胞产品药学研究与评价技术指导原则(征求意见稿)》。
文中明确指出,“干细胞产品生产中应尽量避免使用人源或动物源性材料,尽可能采用组成成分明确的非动物源性试剂,在早期研发筛选无人源或动物源性物料生产工艺。”。

本次征求意见稿依然强调了使用成分明确的非动物源性试剂培养干细胞的重要性。使用血清体系并非不可,但血清组分复杂,有动物来源,不同批次血清有批间差,生产企业需建立血清库用于区分不同批次血清所培养细胞的差异性以及残留,对于细胞生产工作更加繁琐,需要做更多的内控检测项目。
友康生物间充质干细胞无血清培养基,无人源无动物源,为真正成分明确的纯因子无血清培养体系,已获美国FDA二类医疗器械注册受理510(K)号:K190983。更加适合细胞报药与临床研究。


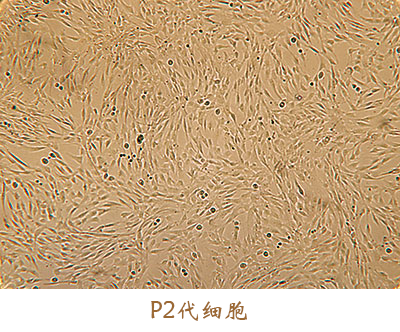
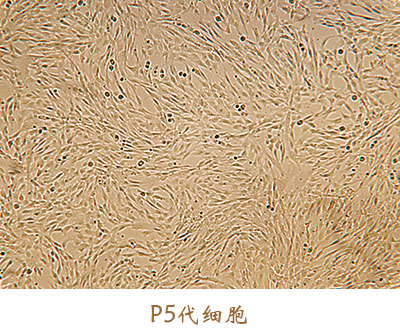
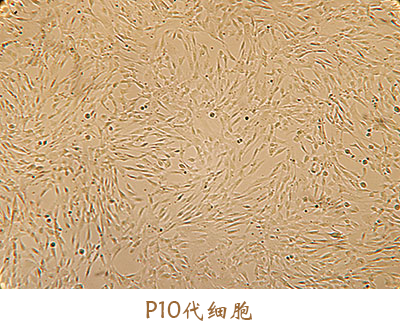
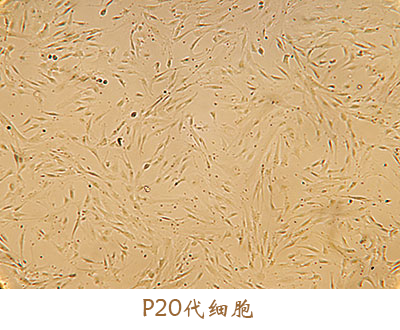
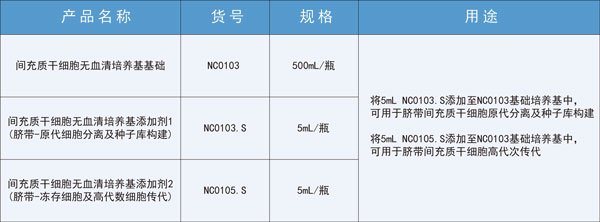
此外,征求意见稿中提到,“按照药品开发的干细胞产品所用辅料的来源、用量和质量控制应基于风险评估的原则,应证明其使用的安全性”。安全是细胞药物开发的核心,应从源头处进行控制。友康间充质干细胞无血清培养基在美国FDA指定实验室做了以下生物相容性及毒性试验,自证我们的培养基绝对安全。虽耗时长久,然砥砺前行。

友康生物,专注于无血清培养,在细胞治疗产业政策进一步明朗之际,我们将持续精耕细作,助我们的用户发展的更快更好!

 Yocon Market
Yocon Market 2021-08-18
2021-08-18 公司热点
公司热点



