iPSC:改写生命程序的“万能细胞”
一、起源:从科学猜想到医学革命
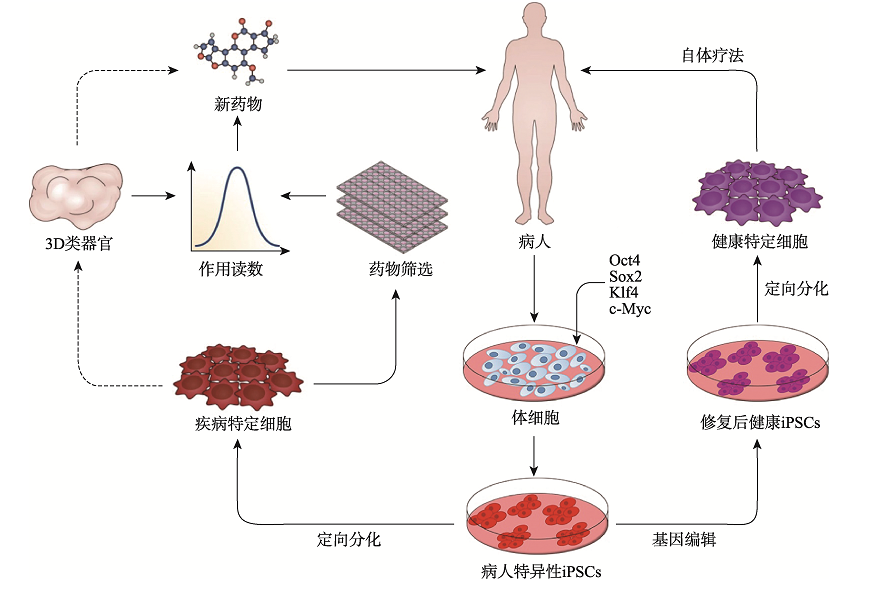
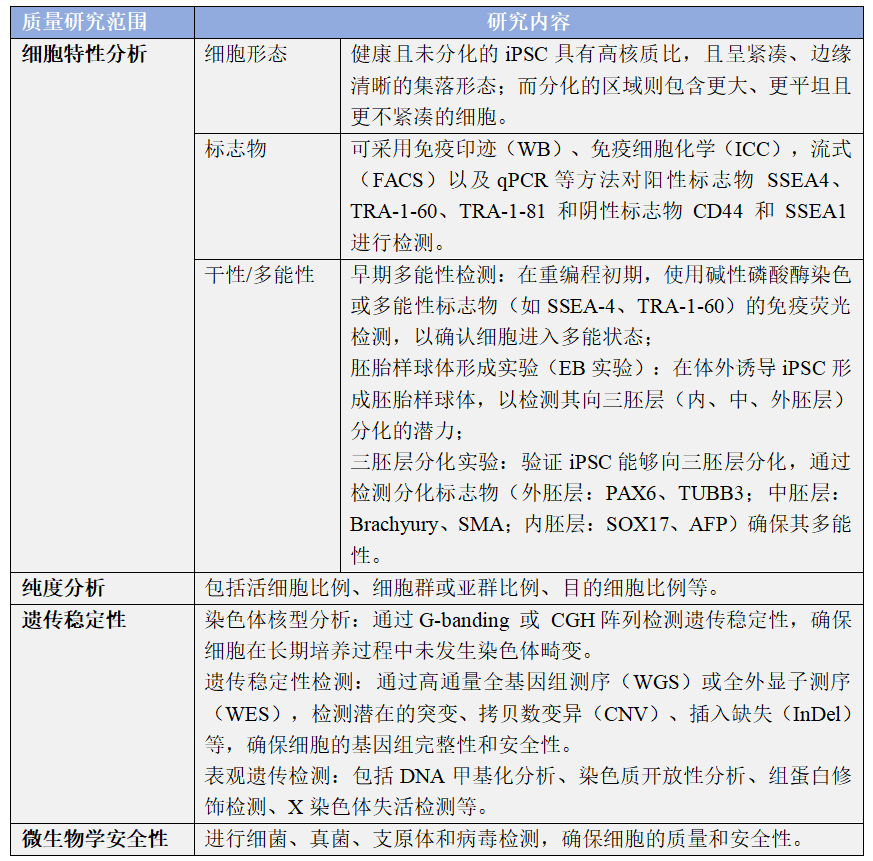
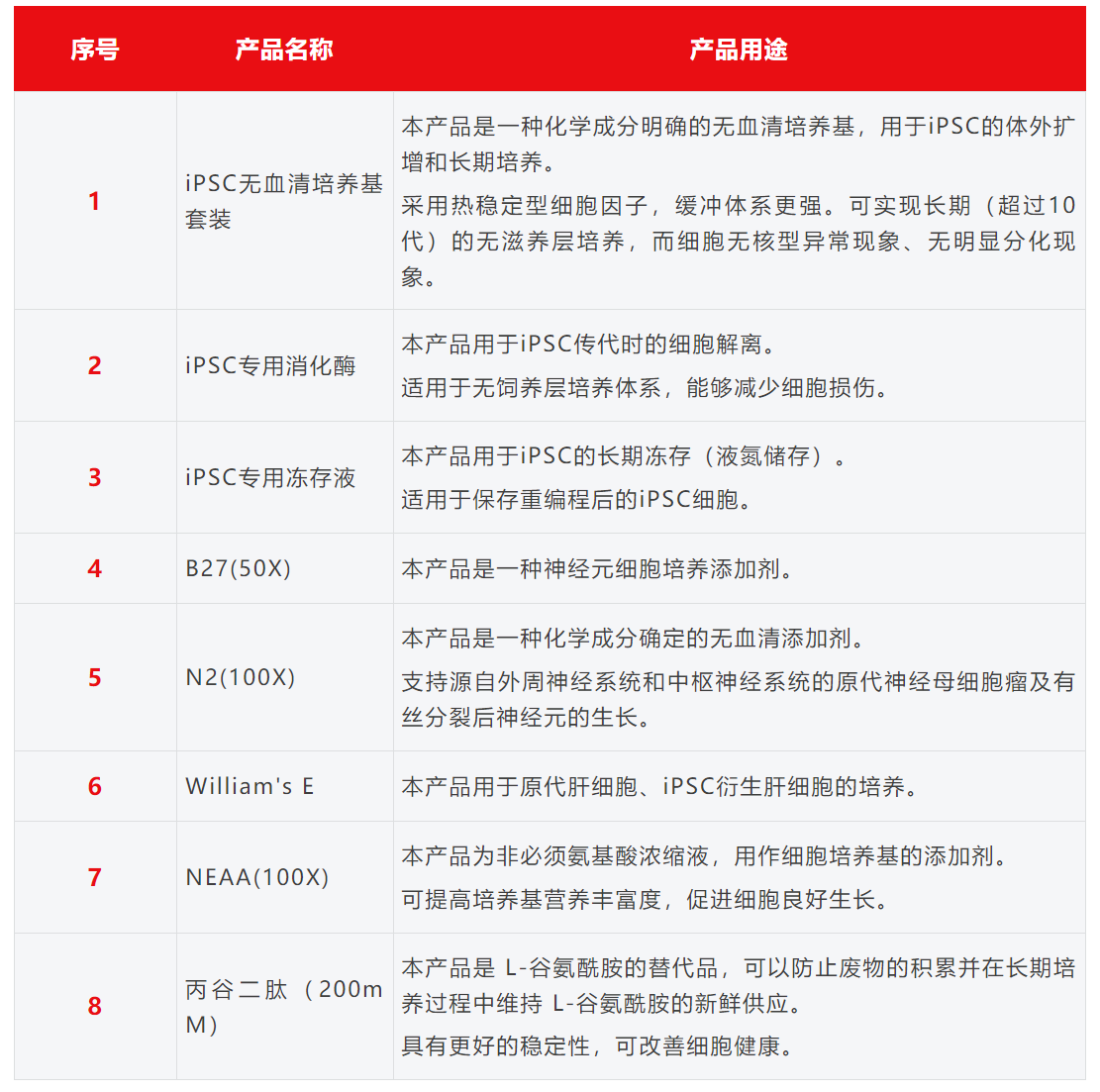
2006年,日本科学家山中伸弥(Shinya Yamanaka)团队在《Cell》上发表了一项震惊世界的研究:他们通过向小鼠成纤维细胞导入四个关键基因(Oct4、Sox2、c-Myc、Klf4),成功将其“逆转”为具有胚胎干细胞特性的细胞——诱导多能干细胞(iPSC)。这一发现不仅实现了体细胞的重编程,更绕过了胚胎干细胞的伦理争议,被《Science》誉为“21世纪最伟大的生物技术突破之一”。 其实早在1999年,山中伸弥就提出了“通过外源因子诱导细胞返老还童”的大胆猜想。经过数年筛选,团队从24个候选基因中锁定上述四因子组合。2007年,这一技术在人类细胞中同样取得成功。美国科学家James Thomson团队也几乎同步实现了人类iPSC的制备,他们采用了略有不同的因子组合(Oct4、Sox2、Nanog、Lin28),进一步验证了该技术的普适性。 2013年,日本Masayo Takahashi教授团队将iPSC定向诱导为视网膜色素上皮细胞,并成功用于治疗一名年龄相关性黄斑变性患者,这成为历史上第一个将iPSC移植到人体中的细胞治疗案例,标志着iPSC技术正式从实验室走向临床实践。 2022年,北京大学邓宏魁团队革新了这一技术,仅用化学小分子(无需基因编辑)即可完成重编程,实现诱导多能干细胞(CiPSC)的制备,避免了基因组插入突变的风险,开启了诱导多能干细胞技术3.0时代。 二、核心特征:为什么iPSC是医学界的“希望之星”? 诱导多能干细胞(iPSC)作为干细胞家族的重要成员,兼具多能性(Pluripotency)与自我更新能力(Self-renewal)两大干性特征,具备以下优势: 1、分化潜能的系统性覆盖 由于iPSC具备分化形成内胚层(形成内脏器官)、中胚层(形成骨骼和肌肉等)、外胚层(形成皮肤和神经组织)三胚层细胞的能力,可根据需求诱导分化成需要的细胞株,对应人类疾病受累的各系统的细胞和组织,因此可应用的疾病范围极为广泛。 2、体细胞来源的广泛性与易获取性 多种体细胞均可用于iPSC的制备,如血液细胞,尿液上皮细胞,皮肤成纤维细胞等,极大程度上解决了很多疾病无法取材的问题。 3、伦理合规性的显著优势 区别于胚胎干细胞(ESC)依赖囊胚期胚胎的获取方式,iPSC源于已分化的成体细胞,完全规避了胚胎破坏带来的伦理争议。 4、规避免疫排斥风险 iPSC可来源于患者自身体细胞,可有效避免异体移植免疫排斥带来的风险。 5、工业化大规模生产能力 在合适的体外培养条件下,iPSC可稳定传代超过10代而不出现核型异常,并定向分化为高纯度功能细胞,确保批间一致性与药效稳定性,为大规模细胞生产提供了关键保障,满足临床治疗对细胞数量的苛刻需求。 三、应用场景:从实验室到临床的跨越 自iPSC问世以来,干细胞生物学和再生医学取得了巨大进展。人类iPSC技术已广泛用于再生医学、疾病建模、药物发现和细胞治疗开发。 1、再生医学和细胞治疗 在全球范围内,有关iPSC的临床试验正在广泛开展,iPSC已经被用于治疗黄斑变性、心脏衰竭、帕金森病和脊髓损伤等多种疾病的临床试验。此外,越来越多的公司开始探索基于iPSC来源的MSC、NK、CAR-T细胞疗法等,以期降低成本提高药物的可及性。 2、疾病建模和毒理学测试 iPSC能够生成与人类疾病高度相关的细胞模型,从而帮助特定疾病,尤其是罕见病患者匹配合适的治疗方案。还可以利用iPSC来进行毒理学测试,帮助评估药物或化学物质的安全性和副作用。 3、药物开发和个性化医疗 iPSC能够分化成各种细胞类型,用于药物靶点验证、化合物筛选和药效研究,从而加速新药的开发过程。同时,iPSC结合基因编辑技术,如CRISPR,可用于定制患者特异性的治疗方案,实现个性化医疗。 4、组织工程和3D生物打印 iPSC能够与生物支架结合,生成类似天然组织的结构,用于修复皮肤、软骨或血管等。此外,iPSC还被用于3D生物打印,打印功能性组织或器官,服务于研究、测试或移植需求。 四、质量管控与工业化挑战:如何量产“生命种子”? 尽管当前iPSC已成为一种极具前景的、来源于患者的无限细胞资源,但由于多能干细胞对支持基质的依赖以及其多能状态的敏感性,在大规模生产iPSC的过程中,确保其质量和多能性以满足临床需求面临着诸多挑战。而维持多能状态和自我更新对于生产临床级iPSC至关重要,因此在整个培养阶段需要及时进行细胞质量鉴定。 在iPSC未分化阶段的培养过程中,需要重点关注以下关键要点: 1、培养条件:将重编程后的细胞在特定的无血清培养基中培养,并控制培养环境,注意细胞传代时间和传代密度,促使细胞形成典型的iPSC克隆。 2、培养代数把控:早期重编程的iPSC不稳定,建议培养到第15代后进行质量鉴定,确认其具备iPSC特征与分化潜能。 3、定期遗传监测:长期传代培养时,建议定期对细胞系进行鉴定,防止染色体和遗传变异影响细胞系。 4、细胞状态观察:iPSC有自发分化倾向,5-10%属于正常,传代时去除分化区域即可。若分化区域过多、细胞形态或增殖速度异常,需及时处理。 五、结语:一场正在发生的医学革命 从实验室到临床,iPSC正以惊人的速度改写医学规则,被誉为是继药物治疗和手术治疗之后的第三次医学革命。它不仅让“定制器官”成为可能,更让人类看到攻克各种顽疾和罕见病的曙光。 事实上,任何新兴技术的成熟都离不开持续迭代,iPSC技术也不例外。尽管应用初期面临遗传稳定性、分化效率等安全性挑战,但随着重编程技术、培养体系和质量控制的优化,理论与实践的鸿沟正逐步弥合。从基础机制解析到临床级细胞库建立,iPSC技术的突破不断夯实转化基石。相信未来,iPSC将以更高安全性和效率,为器官再生、疾病建模和精准细胞治疗开辟新路径,惠及亿万患者。 友康生物多年来一直专注于细胞治疗领域的无血清培养产品研发与生产,于2025年4月20日正式推出iPSC系列产品。 该系列产品涵盖了iPSC细胞扩增培养的核心产品,包括iPSC无血清培养基、iPSC专用细胞冻存液、iPSC专用细胞消化酶;同时还包括用于iPSC细胞后续分化培养的基础培养基及配套试剂。友康生物的iPSC系列产品,将为从事iPSC产品开发的企业与科研单位,提供高品质、成本可控且产品线完整的可靠供应链支持,助力推动iPSC细胞治疗领域的进一步发展。 扫码联系友康,试用产品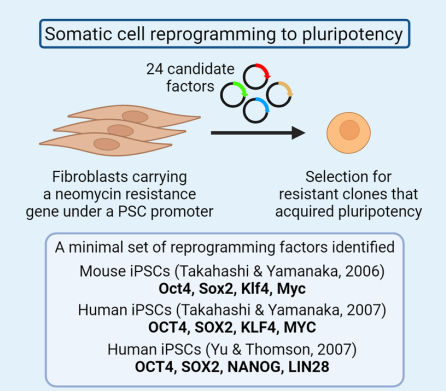


 友康生物
友康生物 2025-05-09
2025-05-09 公司热点
公司热点



