
友康生物的干细胞无血清培养基在美国FDA的510K二类医疗器械注册获得批准,注册证号K232543,是美国FDA发放的全球第2个,中国首个该产品的注册证。
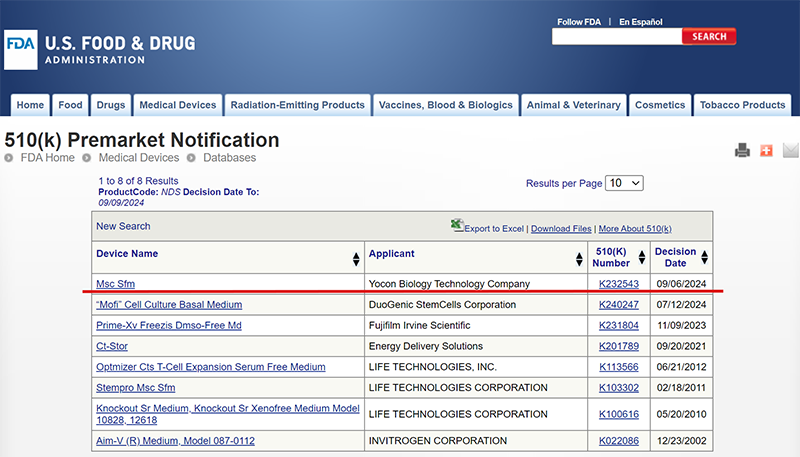
干细胞无血清培养基,用于培养来源于人体脐带、脂肪或骨髓的间充质干细胞,以用作人体疾病治疗或诊断用途。干细胞无血清培养基,沿袭几十年抗体药生产的CHO培养基,293培养基的发展历程,也经历了从血清形式、血替形式,到无血清形式。因其无人源、无动物源、成分明确等特点,消除了很多致敏、致病以及未知的风险隐患,越来越多的被更多药企所青睐。
产品货号:NC0103+NC0103.S点击查看详细产品内容
成分明确的无血清培养基,开发的实质是将上百种不同组分、不同含量的物质以合适组合的形式,形成一个确定的配方。如何从天文数字的排列组合中选择最适合的组合,是产品开发工作的一大挑战。而开发出来的产品,能够通用的适用不同人体来源的脐带、脂肪、骨髓等组织,是该产品的开发的另一大挑战。

无血清培养基培养后的间充质干细胞,或其分泌的外泌体,经医药企业研发后,将以局部注射或静脉回输形式进入人体,治疗诸如糖尿病等慢性疾病,所以干细胞药物在人体的使用会是持续性的长期性的。因此,美国食品药品监管部门对该类产品的安全性极为看重,对培养该细胞药物的无血清培养基制定了极为严格的检测标准,并要求申报企业在遍布全球的美国FDA认可的三方检测实验室完成检测工作。

友康生物2018年在中国市场上推出该产品,并同步启动该产品在美国市场的注册工作。该产品历经6年销售,已经在国内外拥有了上千家客户,并已经与几十家干细胞药物开发企业签订了授权协议,助力其在中国与美国开展干细胞药物申报。
该医疗器械二类注册证书的获得,将大大减少中国干细胞药物开发企业在中国市场与美国市场申请干细胞药物的工作量和不确定性,相信能够助力更多药物开发企业早日获得干细胞药物销售的市场准入。

 友康生物
友康生物 2024-09-12
2024-09-12 公司热点
公司热点



