8月7日,友康第一批GMP级间充质干细胞无血清培养基套装(NC0106)在日本完成清关,预示着友康生物成功开拓日本市场,助力客户收获高质量外泌体。众所周知,日本在细胞治疗领域处于亚洲领先地位,对干细胞治疗的监管体系非常严格,采取了“医疗技术与新药”的双轨监管模式,以确保干细胞治疗产品的安全性和有效性。那么友康生物GMP级间充质干细胞无血清培养基套装为何能够在众多竞品中脱颖而出?
干细胞外泌体作为细胞产物的核心生物制品,其产品的质量与宿主细胞的质量密切相关。在干细胞培养和纯化过程中,传统的干细胞培养基成为最大瓶颈。采用常规干细胞培养基培养,不仅细胞易限制在2D培养环境中,且无法避免杂质颗粒的干扰,效率低杂质多,纯化难度大。在外泌体的分离纯化过程中,相对宽泛的尺寸范围导致外泌体与其他细胞外囊泡混合,从而削弱了外泌体的靶向能力,最终会对外泌体制剂的产品质量产生影响。
因此,要获得临床级别的治疗性外泌体,需对细胞培养条件进行标准化。根据中国食品药品企业质量安全促进会发布公告定制的《人源间充质干细胞外泌体制备与检验规范》(T/FDSA 0049—2024)规定“外泌体应从培养干细胞的条件培养基中获得。条件培养基应避免外源性外泌体的干扰,不包含相应添加物,例如胎牛血清(FBS或FCS)、血小板裂解物、垂体提取物、胆汁盐等其他复合产品。否则应建立方法,以评估培养基中干扰物所产生的影响。”

一、低不溶性微粒含量:优化外泌体样本质量
药用外泌体制剂必须采用GMP级别的生产流程,在其分离与纯化过程中,微粒污染是一项重要挑战。不溶性微粒是指非故意存在于溶液中的除气泡外的可移动的不溶性粒子。它的存在可能会干扰外泌体的分离效果,甚至掩盖外泌体所携带的功能性成分,对产品的稳定性和质量产生影响。
在日本药典中,明确提出对培养基中不溶性颗粒物检测的标准要达到注射针剂的标准,即“使用光阻法进行测定时,标示量在100mL以上的注射剂,每毫升中含10μm以上的微粒数不超过25个,25μm以上的微粒数不超过3个;标示量小于100mL的注射剂,10μm以上的微粒数不超过6000个,25μm以上的微粒数不超过600个。”

为使广大客户用得放心,友康GMP级间充质干细胞无血清培养基套装在设计之初就经过严格的质量控制,并委托第三方机构严格依据药典中不溶性微粒检查法(光阻法)进行检测,结果显示每毫升样品中10μm以上的微粒数为22粒,25μm以上的微粒数仅为1粒。这一数据充分证明了友康生物在保障培养基纯净度与安全性方面的不懈努力与显著成效,为客户在外泌体及干细胞相关领域的广泛应用提供了可靠的技术支持与保障。

二、少量重组蛋白:提高外泌体得率与纯度
多项研究发现,含有胎牛血清(FBS)的培养基会对培养细胞的生理状态、外泌体的产生或释放产生影响。并且由于FBS内含不明成分的囊泡和非囊泡颗粒污染物(如EVs、脂蛋白、蛋白复合体等),与外泌体具有相似的大小、密度或RNA成分,也会影响外泌体的体内外功能研究。此外,从实验设计优化的角度出发,减少前端引入的杂蛋白含量,直接关联到后续纯化过程中杂蛋白去除步骤的简化。这意味着每减少一次纯化步骤,就能减少浪费,提高外泌体的得率。因此,迫切需要一款无血清、低蛋白且化学成分明确的培养基来满足干细胞外泌体的上游细胞培养需要。
友康GMP级间充质干细胞无血清培养基套装是一套适用于MSC细胞的无血清、化学成分限定培养基,不含任何动物源及人源成分,细胞培养过程中无需添加血清或血小板裂解物,极大地减少了外源蛋白的引入,降低了下游纯化系统的操作难点,提高外泌体终产品的得率与纯度。产品批间差异小且所有原料均符合GMP标准,更适合临床研究用途。
三、支持3D扩大培养:满足工业化大规模外泌体生产需求
外泌体药物从小规模研发扩展到工业化规模生产,并进入后续临床试验的过程中,临床级外泌体的大规模生产面临重大挑战。外泌体的产量高度依赖于其供体细胞,受限于不同细胞分泌外泌体的能力以及大规模细胞培养的困难与高成本。目前,相较于2D培养方法,3D培养系统如中空纤维生物反应器、搅拌悬浮式生物反应器等解决了单层贴壁细胞表面积有限这一问题,可以短时间内培养大量细胞制造外泌体。
友康GMP级间充质干细胞无血清培养基套装不仅能够改善细胞贴壁与适应能力,并且对于培养基体系更换或培养耗材更换的适应力极强。细胞形态无论在早期还是高代次均呈现颗粒分明的短梭形,在P10以上代次仅有扩增倍数的下降,但基本没有呈片状老化的细胞,支持细胞工厂及微载体等大规模3D培养体系,为外泌体的大规模制备与应用提供了有力的上游支撑。
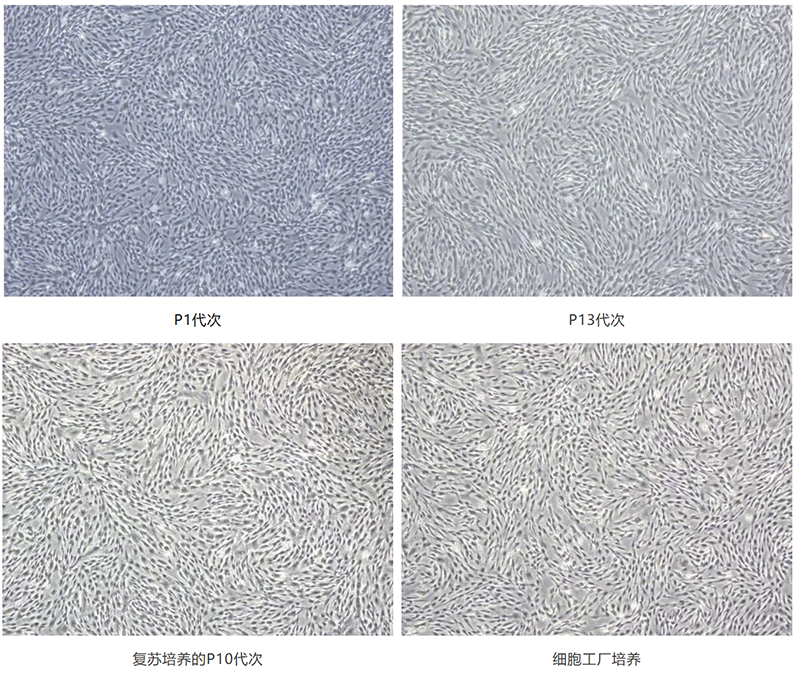
综上,凭借其卓越的不溶性微粒控制水平,精简的蛋白组分以及支持高效的3D扩大培养技术,友康GMP级间充质干细胞无血清培养基套装能够有效保障外泌体的得率和安全性,助力客户收获高质量外泌体终产品。

 友康生物
友康生物 2024-10-10
2024-10-10 公司热点
公司热点



